Le tableau périodique des éléments, principalement créé par le chimiste russe, Dmitry Mendeleev (1834-1907), a célébré sa 150e anniversaire l’année dernière. Il serait difficile de surestimer son importance en tant que principe organisateur de la chimie – tous les chimistes en herbe s’y familiarisent dès les premiers stades de leur formation.
Compte tenu de l’importance du tableau, on pourrait être pardonné de penser que l’ordre des éléments n’est plus sujet à débat. Cependant, deux scientifiques de Moscou, en Russie, ont récemment publié un proposition de nouvelle commande.
Voyons d’abord comment le tableau périodique a été développé. À la fin du 18e siècle, les chimistes étaient clairs sur la différence entre un élément et un composé: les éléments étaient chimiquement indivisibles (les exemples sont l’hydrogène, l’oxygène) tandis que les composés se composaient de deux éléments ou plus en combinaison, ayant des propriétés tout à fait distinctes de leurs éléments constitutifs.
Au début du 19e siècle, il y avait bonne preuve circonstancielle pour l’existence d’atomes. Et dans les années 1860, il était possible d’énumérer les éléments connus dans l’ordre de leur masse atomique relative – par exemple, l’hydrogène était de 1 et l’oxygène de 16.
Les listes simples, bien sûr, sont de nature unidimensionnelle. Mais les chimistes étaient conscients que certains éléments avaient des propriétés chimiques assez similaires: par exemple le lithium, le sodium et le potassium ou le chlore, le brome et l’iode.
Quelque chose semblait se répéter et en plaçant des éléments chimiquement similaires les uns à côté des autres, un tableau bidimensionnel pouvait être construit. Le tableau périodique est né.
Surtout, le tableau périodique de Mendeleev avait été dérivé empiriquement sur la base des similitudes chimiques observées de certains éléments. Ce n’est qu’au début du XXe siècle, après l’établissement de la structure de l’atome et suite au développement de la théorie quantique, qu’une compréhension théorique de sa structure émergera.
Les éléments étaient maintenant classés par numéro atomique (le nombre de particules chargées positivement appelées protons dans le noyau atomique), plutôt que par masse atomique, mais toujours aussi par similitudes chimiques.
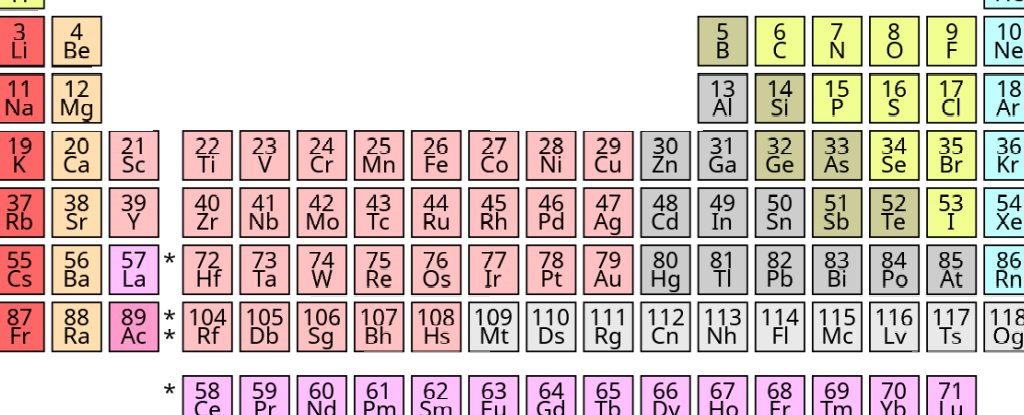
Mais ce dernier découlait maintenant de l’arrangement d’électrons se répétant dans des soi-disant «coquilles» à intervalles réguliers. Dans les années 1940, la plupart des manuels comportaient un tableau périodique similaire à ceux que nous voyons aujourd’hui, comme le montre la figure ci-dessous.

Il serait compréhensible de penser que ce serait la fin du problème. Mais pas du tout. Une simple recherche sur Internet révélera toutes sortes de versions du tableau périodique.
Il existe des versions courtes, des versions longues, des versions circulaires, des versions en spirale et même des versions en trois dimensions. Bien sûr, bon nombre d’entre eux sont simplement des moyens différents de transmettre les mêmes informations, mais des désaccords persistent sur l’endroit où certains éléments devraient être placés.
Le placement précis de certains éléments dépend des propriétés particulières que nous souhaitons mettre en évidence. Ainsi, un tableau périodique qui donne la primauté à la structure électronique des atomes différera des tableaux dont les principaux critères sont certaines propriétés chimiques ou physiques.
Ces versions ne diffèrent pas beaucoup, mais il y a certains éléments – l’hydrogène par exemple – que l’on pourrait placer tout à fait différemment selon la propriété particulière que l’on souhaite mettre en évidence. Certaines tables placent l’hydrogène dans le groupe 1 tandis que dans d’autres, il se situe au sommet du groupe 17; certaines tables l’ont même dans un groupe seul.
Un peu plus radicalement, cependant, nous pouvons également envisager d’ordonner les éléments d’une manière très différente, qui n’implique pas de numéro atomique ou ne reflète pas la structure électronique – revenant à une liste unidimensionnelle.
Nouvelle proposition
La dernière tentative d’ordonner les éléments de cette manière a récemment été publié dans le Journal de chimie physique par des scientifiques Zahed Allahyari et Artem Oganov.

Leur approche, s’appuyant sur les travaux antérieurs des autres, consiste à attribuer à chaque élément ce qu’on appelle un nombre de Mendeleev (MN).
Il existe plusieurs façons de dériver de tels nombres, mais la dernière étude utilise une combinaison de deux grandeurs fondamentales qui peuvent être mesurées directement: le rayon atomique d’un élément et une propriété appelée électronégativité qui décrit la force avec laquelle un atome attire les électrons vers lui-même.
Si l’on ordonne les éléments par leur MN, les voisins les plus proches ont, sans surprise, des MN assez similaires. Mais il est plus utile d’aller plus loin et de construire une grille bidimensionnelle basée sur le MN des éléments constitutifs dans ce que l’on appelle des “composés binaires”.
Ce sont des composés composés de deux éléments, tels que le chlorure de sodium, NaCl.
Quel est l’avantage de cette approche? Surtout, cela peut aider à prédire les propriétés de composés binaires qui n’ont pas encore été fabriqués. Ceci est utile dans la recherche de nouveaux matériaux qui sont probablement nécessaires pour les technologies futures et existantes. Avec le temps, il ne fait aucun doute que cela sera étendu aux composés contenant plus de deux composants élémentaires.
Un bon exemple de l’importance de la recherche de nouveaux matériaux peut être apprécié en examinant le tableau périodique présenté dans la figure ci-dessous.

Ce tableau illustre non seulement l’abondance relative des éléments (plus la boîte de chaque élément est grande, plus il y en a) mais met également en évidence les problèmes d’approvisionnement potentiels liés aux technologies devenues omniprésentes et essentielles dans notre vie quotidienne.
Prenez les téléphones portables, par exemple. Tous les éléments utilisés dans leur fabrication sont identifiés par l’icône du téléphone et vous pouvez voir que plusieurs éléments nécessaires se raréfient – leur approvisionnement futur est incertain.
Si nous devons développer des matériaux de remplacement qui évitent l’utilisation de certains éléments, les connaissances acquises en commandant les éléments par leur MN peuvent s’avérer utiles dans cette recherche.
Après 150 ans, nous pouvons constater que les tableaux périodiques ne sont pas seulement un outil pédagogique essentiel, ils restent utiles aux chercheurs dans leur quête de nouveaux matériaux essentiels. Mais nous ne devons pas penser que les nouvelles versions remplacent les représentations précédentes. Avoir de nombreux tableaux et listes différents ne sert qu’à approfondir notre compréhension du comportement des éléments.
Nick Norman, Professeur de chimie, Université de Bristol.
Cet article est republié à partir de La conversation sous une licence Creative Commons. Lis le article original.

“Introverti hardcore. Pionnier de la bière. Amoureux d’Internet. Analyste. Spécialiste de l’alimentation. Passionné de médias sociaux.”






